
|



| 产地 | 中国/上海 |
| 品牌 | LMAI Bio |
| 货号 | LM82402D |
| 用途 | 本产品只适用于科研,不能用于临床诊断。严禁用于临床医疗及其他非科研用途! 以实际收货产品说明书为准,网站说明书仅供参考。 |
| 包装规格 | 20T |
| 是否进口 | 否 |
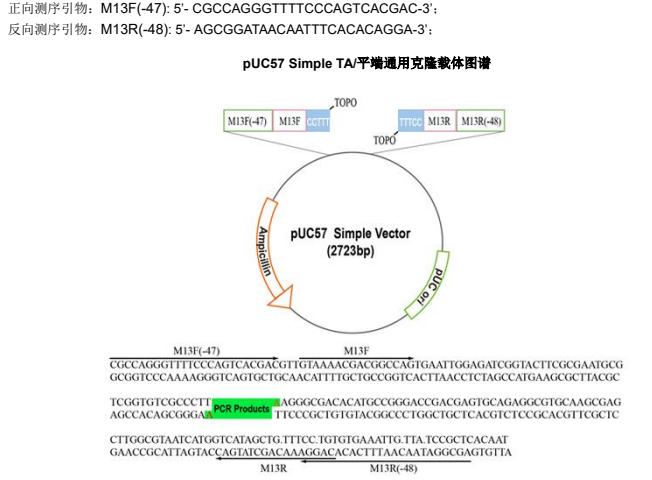
pUC57 Simple TA/平端通用克隆载体
描述:
pUC57 Simple 通用克隆载体采用了 TOPO 酶连接技术,载体预先偶联上 TOPO 酶,当加入 PCR 扩增产物后,5 min就可以完成连接反应,连接阳性率高。pUC57 Simple 通用克隆载体消除了大部分的常用酶切位点,便于后续亚克隆。该产品适用于 Taq 酶扩增的含“A”尾巴和高保真酶扩增的 PCR 产物的连接,载体含有氨苄青霉素抗性筛选标记。
组分

注意:RTS DH5α 冻干感受态在未溶解状态下,可于-20℃长期保存(>2 年),已经溶解后,请-60℃以下保存(3 个月)。
主要特征
(1)快速连接, 仅需 5min;(2)操作简单,仅需加入载体和片段即可;(3)无需蓝白斑筛选,阳性率高;(4)不包含任何酶切位点,便于后续亚克隆(5)平末端和 A 尾产物通用。
注意:引物不能磷酸化。
测序引物
操作步骤
1. PCR 产物的纯化
1.1 PCR 扩增完毕后,电泳检测产物,如无非特异性扩增、无引物二聚体、条带单一明亮,则可采用 PCR 产物纯化试剂盒纯化后用于连接。产物不经纯化也可以进行连接,但效果稍差一些。
1.2 PCR 扩增完毕后,电泳检测产物,如有非特异性扩增条带或引物二聚体,则必须采用胶回收后用于连接。
1.3 PCR 扩增模板来源于 Amp 抗性质粒,则必须采用胶回收后用于连接。
2. PCR 用量和连接时间
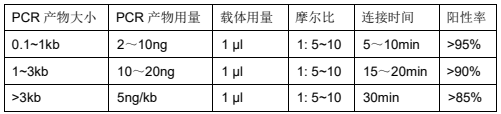

关于 PCR 产物的用量说明:在 PCR 产物回收后(在无法进行 NanoDrop 测定浓度的情况下),按照一般的经验可估算产物的用量,原则为:3 μl 回收产物在琼脂糖凝胶电泳后,可清晰判断的情况下,使用 0.5~1 μl 回收产物(约 5~15 ng)进行连接即可。回收产物难以观察的情况下使用 4 μl 回收产物(约 5~10 ng)进行连接。使用过高量的 PCR 产物将会导致连接效率低下,长斑数量和阳性率急剧下降。
4. 转化(以 RTS DH5α 克隆感受态细胞为例说明)
4.1 从-20°C 冰箱中取出 Nano E.coli Transfection Reagent 融化,放置于冰上。取 300 μl Nano E.coli Transfection Reagent 加入到一支冻干感受态细胞中,并分装到 10 支 1.5 ml EP 管中(每支 30 μl),于-60°C 以下保存(或立即使用)。
4.2 将 5 μl 连接产物加入到分装的感受态细胞中,轻弹 EP 管(或枪头轻轻吹打),置于冰上 15 min。
注意:放置时间不要超过 30 min,过长时间会导致核酸聚合,从而影响转化效价。
4.3 置于 42°C 热激 1min 后,迅速置于冰上急冷 2 min。
4.4 热激完毕后,向上述感受态细胞中加入 450 μL 不含抗生素的 SOC(或 LB)培养基,37°C 振荡(225 rpm)培养 60 min。
使质粒上抗性标记基因表达,菌体复苏。
4.5 取 200 μL 复苏菌液涂布到含相应抗生素的 LB 琼脂平板表面。
4.6 将平板置于 37°C 培养,12~18 小时后可出现菌落。
注意:如使用液体感受态,直接将 5 μl 连接后产物加入到液体感受态,并参照液体感受态操作方法即可。
5. PCR 菌检挑选阳性克隆菌落(连接产物条带单一、清晰情况下,阳性率>95%,可无需菌检,直接测序,本步骤可省略)
5.1 用 10 μl Tip 头挑取生长良好的单个菌斑,放置于 10 μl 无菌水中吹打几次混合均匀。
5.2 取 1 μl 上述菌液于 20 μl PCR 体系中,用 PCR 特异性引物或者 M13F(-47)和 M13R(-48)鉴定阳性克隆。
5.3 以上述菌液为模板进行 PCR 扩增,并电泳检测(如载体自连接,则菌检 PCR 扩增长度为:140bp)。

6. 质粒提取及测序
将鉴定为阳性的菌液接种于 5ml LB 培养基中(含 100ug/ml 氨苄青霉素),37°C 振荡(225 rpm)培养过夜,提取质粒。并使用 M13F(-47)或 M13R(-48)进行测序。
临床诊断。严禁用于临床医疗及其他非科研用途!以实际收货产品说明书为准,网站说明书仅供参考。