
|





| 产地 | 上海 |
| 品牌 | 联迈生物 |
| 货号 | LM-876681S |
| 用途 | SS-Ⅰ催化蔗糖和UDP生成游离果糖和UDPG,采用3,5-二硝基水杨酸法测定还原糖的含量来反映酶活性的高低。 |
| 包装规格 | 100管/48样 |
| 纯度 | 99% |
| CAS编号 | |
| 是否进口 | 否 |
蔗糖合成酶(分解方向 SS-Ⅰ)测试盒/微量法说明书
测定意义:
蔗糖是源(叶片等)光合产物向“库”器官运输的主要形态。蔗糖合成酶(Sucrose Synthase, EC 2.4.1.13)是双向反应酶,既可催化蔗糖合成又可催化蔗糖分解,是蔗糖代谢的关键酶之一。研究其分解方向 SS-Ⅰ的活性对于植物蔗糖降解以及淀粉合成具有重要意义。

测定原理:
SS-Ⅰ催化蔗糖和UDP生成游离果糖和UDPG,采用3,5-二硝基水杨酸法测定还原糖的含量来反映酶活性的高低。
混匀,取 200μL 至微量石英比色皿或 96 孔板中,540nm 下测定各管吸光值。ΔA=A 测定-A 对照。每个测定管需要设一个对照管。
需自备的仪器和用品:
可见分光光度计/酶标仪、水浴锅、离心机、移液器、微量石英比色皿/96 孔板、研钵、冰
试剂的组成和配制:
提取液:液体 100mL×1 瓶,4℃保存;
试剂一:液体 10mL×1 瓶,4℃保存;
试剂二: 液体 5mL×1 瓶,4℃保存;
试剂三:粉剂×2 支,-20℃保存;临用前每支加入 1.2mL 试剂二充分溶解待用,现配现用;
试剂四:液体 6mL×1 瓶,4℃保存。
样品测定的准备:
按照组织质量(g):提取液体积(mL)为 1:5~10 的比例(建议称取约 0.1g 组织,加入 1mL 提取液),进行冰浴匀浆。8000g 4℃离心 10min,取上清,置冰上待测。
测定步骤:
1、 分光光度计或酶标仪预热 30min 以上,调节波长至 540nm,蒸馏水调零。
2、 样本测定,(在 EP 管中依次加入下列试剂):
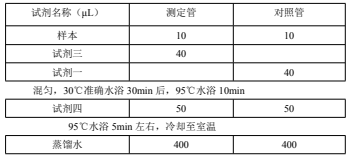
SS-Ⅰ活性计算:
a.用微量石英比色皿测定的计算公式如下
1、标准条件下测定回归方程为 y = 0.0012x - 0.0492;x 为标准品浓度(μg/mL),y 为ΔA。
2、按照蛋白浓度计算
单位定义:每 mg 组织蛋白每分钟催化产生 1μg 还原糖定义为一个酶活力单位。
SS-Ⅰ活性(μg /min/mg prot)= (ΔA+0.0492) ÷0.0012×V 反总]÷(V 样×Cpr) ÷T=138.9×(ΔA+0.0492) ÷Cpr
3、按照样本鲜重计算
单位定义:每 g 组织每分钟催化产生 1μg 还原糖定义为一个酶活力单位。
SS-Ⅰ活性(μg /min/g 鲜重) =(ΔA+0.0492) ÷0.0012×V 反总]÷(W× V 样÷V 样总) ÷T=138.9×(ΔA+0.0492) ÷W
V 反总:反应体系总体积,0.05mL; V 样:加入样本体积,0.01 mL;V 样总:加入提取液体积,1 mL;
T:反应时间,30 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g。
b.用 96 孔板测定的计算公式如下
1、标准条件下测定回归方程为 y = 0.0006x - 0.0492;x 为标准品浓度(μg/mL),y 为ΔA。
2、按照蛋白浓度计算
单位定义:每 mg 组织蛋白每分钟催化产生 1μg 还原糖定义为一个酶活力单位。
SS-Ⅰ活性(μg /min/mg prot)= (ΔA+0.0492) ÷0.0006×V 反总]÷(V 样×Cpr) ÷T=277.8×(ΔA+0.0492) ÷Cpr
3、按照样本鲜重计算
单位定义:每 g 组织每分钟催化产生 1μg 还原糖定义为一个酶活力单位。
SS-Ⅰ活性(μg /min/g 鲜重) =(ΔA+0.0492) ÷0.0006×V 反总]÷(W× V 样÷V 样总) ÷T=277.8×(ΔA+0.0492) ÷W
V 反总:反应体系总体积,0.05mL; V 样:加入样本体积,0.01 mL;V 样总:加入提取液体积,1 mL;
T:反应时间,30 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g。
本产品只适用于科研,不能用于临床诊断。严禁用于临床医疗及其他非科研用途!以实际收货产品说明书为准,网站说明书仅供参考。